Vol. 12, n. 1 (2020)
L’uomo da sempre si è adoperato per conoscere il mondo che lo circonda, la natura e l’universo intero. Però mentre per le antiche civiltà mesopotamiche ed egizie, la conoscenza veniva garantita dalle divinità, l’uomo della Grecia del VII secolo a.C. incominciò con sistematicità ad osservare il mondo fisico, vegetale e animale per cercare una spiegazione razionale riguardo al principio che lo aveva generato. All’inizio di questa evoluzione che porterà all’impostazione del metodo scientifico troviamo Talete da Mileto (624-546 a.C.), ricordato come uno dei sette saggi dell’età arcaica e che Aristotele considera come “l’iniziatore della filosofia che cerca la ragione e il principio da cui nasce tutta la realtà nelle sue svariate manifestazioni”. Talete considerava l’acqua il “principio primo” da cui provenivano tutte le cose e la sua filosofia fu chiamata “monista” o anche “riduzionista”. Il “monismo” fu sostenuto da diversi filosofi fino al V secolo quando la ricerca del principio primo prese una strada nuova: l’origine di tutte le cose doveva essere spiegata dall’intervento di più principi. I pensatori che seguirono questa idea furono chiamati “fisici pluralisti” perché si occupavano della natura e ritenevano che essa fosse formata da una molteplicità di sostanze generatrici. Tra questi troviamo Leucippo di Mileto (della scuola di Talete) che con il suo allievo Democrito di Abdera, diede vita a quello che venne in seguito chiamato l’Atomismo. La loro fu definita una “teoria corpuscolare meccanicistica” nella quale gli atomi, eterni, solidi e impenetrabili dotati di moto vorticoso, potevano raggrupparsi a seguito degli urti e dare origine alle cose esistenti. I due ricercatori operarono approssimativamente tra il 450 e il 370 a.C. e pensavano che qualsiasi porzione di materia potesse essere divisa in parti sempre più piccole fino ad arrivare ad un frammento minimo, indivisibile chiamato “atomos” dove la “a” privativa indicava proprio che quel frammento non poteva più essere diviso. Questo termine di Democrito è entrato nella scienza moderna come “atomo”: la più piccola parte di un elemento chimico che mantiene le proprietà dell’elemento stesso. Soltanto due millenni più tardi gli esperimenti di fisica hanno dimostrato che l’atomo è costituito da particelle “subatomiche” più piccole. Al suo manifestarsi, l’idea dell’atomo democriteo avrebbe meritato più attenta considerazione, ma i filosofi greci, in particolare Platone e Aristotele, lo contrastarono duramente; il primo per la mancanza del creatore delle particelle atomiche e il secondo perché considerava impossibile che un frammento di sostanza non potesse essere diviso all’infinito e poi perché Aristotele non ammetteva l’esistenza del vuoto. Per questi autorevoli dissensi l’atomismo rimase “nel cassetto” per molto tempo anche se alcuni filosofi greci e romani ripresero l’idea qualche secolo dopo la sua apparizione. In particolare intorno al 300 a.C. Epicuro rilanciò in Grecia la filosofia di Democrito e introdusse la eventualità di deviazione spontanea degli atomi dal loro movimento rettilineo per dar luogo alle aggregazioni che formavano la realtà fisica. A Roma, in età repubblicana, l’atomismo fu accolto e diffuso da Lucrezio (95-55 a.C.) che ripropose la teoria nel poema “De rerum natura” ripresa poi dai filosofi post-aristotelici nel XVI secolo. Il poema di Lucrezio non è soltanto una riproposizione della filosofia atomistica, ma è un inno ad Epicuro che secondo il poeta e filosofo romano, ha reso possibile la comprensione del mondo. “Te seguo, onor della Grecia ed… imprimo i miei passi sulle orme del tuo piede… perché…pieno d’amore intendo imitarti…. Tu, padre, hai trovato la verità; tu ci prodighi paterni precetti. …. Appena la tua ragione ha cominciato a proclamare…. quale sia la natura di tutte le cose, ecco svanire i terrori del cuore, dileguarsi le barriere del mondo (1). Naturalmente accettò la deviazione spontanea introdotta da Epicuro e, latinamente, la chiamò “clinamen”. L’atomismo fu combattuto nel periodo greco e romano e soprattutto nel medioevo, per motivi filosofici e religiosi, in particolare era accusato di materialismo ed ateismo. Tuttavia nella prima metà del 1500 la rivoluzione copernicana diede il primo colpo all’astronomia aristotelica e successivamente l’attacco al filosofo greco si spostò verso la costituzione della materia, dello spazio e del vuoto; comparvero i filosofi “corpuscolaristi” e filosofi “atomisti”, e da quel momento l’atomismo incominciò ad avere influenza sulla ricerca scientifica concernente l’universo. Il compito di combattere la fisica e la metafisica di Aristotele non era però facile e privo di inconvenienti; alcuni atomisti che intendevano organizzare un dibattito per confutare alcuni principi aristotelici furono banditi da Parigi e minacciati di pene corporali. Tuttavia nel XVII secolo l’atomismo incominciò ad avere estimatori tra i filosofi e gli scienziati di rilievo e nacque una nuova filosofia e una nuova fisica con Descartes, Galilei, Bacone, Giordano Bruno, Boyle, Hobbes, Gassendi. e altri. Tra questi Gassendi, sacerdote e teologo cristiano, viene ricordato perché si adoperò con sistematicità nell’allontanare dall’atomismo epicureo le implicazioni ateistiche: Dio è creatore dell’universo e quindi anche degli atomi. Anche il fisico Newton, nei primi decenni del 1700, diede vita ad una teoria che considerava la materia costituita da particelle primordiali chiamate “minima”. Tutti gli studiosi ricordati però, hanno in comune il merito di aver creato in Europa la filosofia scientifico-sperimentale che avrebbe poi portato alla scienza moderna. Alla fine del 1700 ed inizio 1800 questa mise in mano agli scienziati strumenti adeguati alla sperimentazione che portò al superamento delle speculazioni. Nel 1808 il chimico e fisico John Dalton presentò la sua composizione della materia basata sugli atomi, ottenuta da evidenze empiriche. Si può riassumere in cinque punti:
- Ogni elemento è costituito da atomi; 2) tutti gli atomi di un elemento sono uguali; 3) gli atomi di elementi diversi sono diversi; 4) nelle reazioni chimiche gli atomi non possono essere creati, distrutti, cambiati o trasmutati e si trasferiscono interi da un composto ad un altro; 5) Gli atomi di un elemento si combinano, per formare un composto, solamente con numeri interi di atomi di altri elementi.
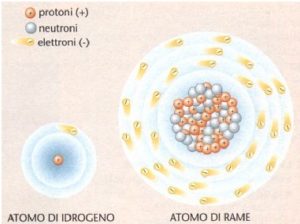
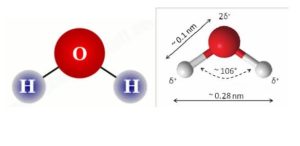
Da Democrito erano passati 22 secoli e si erano ottenute le prime evidenze scientifiche sulla esistenza degli atomi, però dovranno passare ancora circa sessant’anni prima di arrivare alla Tavola Periodica di Mendeleev tanto cara a Primo Levi. Al tempo di Dalton infatti, ancora non era chiara l’esistenza della molecola (aggregazione di atomi) e Dalton stesso, non riconoscendo che certi gas (es. idrogeno e ossigeno) non erano costituiti da atomi ma da molecole biatomiche, interpretava erroneamente certi dati sperimentali. Dieci anni dopo la pubblicazione di Dalton, il chimico italiano Amedeo Avogadro, attraverso i suoi studi in fase gassosa, utilizzando bilancia, termometro, manometro e palloni tarati in volume, fu in grado di dimostrare che un litro di ossigeno, a temperatura e pressione costante, pesava 16 volte più di un litro di idrogeno nelle stesse condizioni sperimentali; poiché era stato dimostrato che le molecole dei due elementi erano costituite da due atomi ciascuna, egli fu in grado di ottenere una scala relativa di peso per gli atomi degli elementi chimici. Questo è stato fatto in primo luogo per gli elementi gassosi, e poi, modificando le procedure sperimentali, anche per gli altri elementi. La chiara e precisa definizione di atomo e molecola venne data da Stanislao Cannizzaro, Università di Genova, ad un congresso di chimica a Karlsruhe nel 1860: si definisce “molecola la quantità di materia che entra in gioco in una reazione….chimica …..intendendo per atomo la quantità minima di una sostanza contenuta in una molecola”. A quel congresso c’era anche Dmitrij Mendeleev, ospite di un laboratorio tedesco, che rientrato in Russia ebbe la cattedra di Chimica Generale. Egli aveva in animo di fare un corso che insegnasse ai suoi studenti, in modo chiaro e semplice, i fondamenti della chimica emersi negli ultimi anni; sentì quindi il bisogno di scrivere un libro che lui considerava una traccia per studenti e lo chiamò “Principi di chimica”. Ebbe l’idea di mettere in ordine di peso atomico crescente, un valore numerico determinabile sperimentalmente con precisione, i 62 elementi allora conosciuti, specificando le proprietà e caratteristiche di ognuno. L’importante scoperta che egli fece fu che le proprietà degli elementi si ripetevano periodicamente all’aumentare del peso atomico e arrivò a definire gruppi di elementi a diverso peso atomico con proprietà simili. Previde inoltre l’esistenza di elementi non ancora scoperti ai quali diede dei nomi provvisori. La tabella che egli compilò prese il nome di Tavola Periodica di Mendeleev (da qui in avanti semplicemente Tavola) ed essa mantiene ancora oggi lo stesso nome anche se è stata modificata più volte. Sono state due le principali modifiche introdotte: l’aggiunta di nuovi elementi e la sostituzione, nella elencazione, del peso atomico con il numero atomico. L’aumento del numero degli elementi fu dovuto in primo luogo al rinvenimento, tra le rocce del nostro pianeta, di 30 nuovi elementi naturali, in parte previsti da Mendeleev e così essi in totale diventarono 92, ultimo numero assegnato all’uranio. Ma poi si aggiunsero diversi elementi artificiali prodotti per sintesi condotta in laboratorio; essi avevano numero atomico superiore a 92 e vennero creati attraverso reazioni che riguardavano il nucleo, così attualmente gli elementi della Tavola sono 118 (l’ultimo è stato registrato nel 2018). La disposizione secondo il numero atomico avvenne quando fu possibile l’acquisizione di questo parametro per via sperimentale tramite nuove scoperte e nuove strumentazioni. Nel 1913, infatti, venne determinato tramite i raggi X, il numero dei protoni; esso corrispondeva al numero atomico che entrò quindi nella Tavola. Fino al 1897 l’atomo era rimasto indivisibile come quello di Democrito, ma in quell’anno incominciarono ad essere individuate le particelle che lo componevano. La prima fu l’elettrone con carica negativa, poi il protone con carica positiva ed infine nel 1932 il neutrone senza carica e con massa quasi uguale a quella del protone. Si dimostrò anche che la massa dei protoni era 1835 volte maggiore di quella degli elettroni e che questi si muovono nel vuoto a grande distanza dal nucleo, come in un minisistema solare, in orbitali a diversa energia e forma. (Figura 1). Per costruire idealmente un atomo, a temperatura e pressione ambiente, dobbiamo introdurre gli elettroni disponibili in base al numero atomico, negli orbitali sistemati intorno al nucleo incominciando da quelli a minor energia, più vicini al nucleo, fino ad arrivare a riempire quelli più esterni, tenendo presente che ogni orbitale può contenere al massimo due elettroni. Quelli che sono negli orbitali più esterni sono chiamati “elettroni di valenza” e sono responsabili dei legami tra gli atomi. Questi infatti hanno la straordinaria capacità di legarsi stabilmente con atomi dello stesso elemento o di elementi diversi, formando aggregati di materia più voluminosi e pesanti chiamati molecole. Gli orbitali contenenti gli elettroni di valenza hanno forme spaziali ben definite ed essi condizionano la struttura delle molecole che si formano (vedere Figura 2) . La struttura a triangolo dei tre atomi dell’acqua viene spiegata dalla disposizione spaziale degli orbitali di valenza dell’ossigeno. Per dare una idea della dimensione dell’atomo, che è la più piccola particella di materia che mantiene le caratteristiche dell’elemento, riporterò una frase dal libro di Massimo Teodorani “L’atomo e le particelle elementari”: ..un piccolo oggetto come una goccia d’acqua, contiene tanti atomi quante sono le gocce d’acqua contenute nel mar Mediterraneo. Con l’accertamento definitivo della struttura dell’atomo e la comprensione dell’origine delle molecole, ha inizio una nuova fase della ricerca chimica ed è quella che ha vissuto Primo Levi che si è laureato nel 1941. Egli scrive che si era iscritto a Chimica per comprendere la materia e che la comprensione della materia era necessaria per comprendere l’Universo. Questo era anche lo scopo di Talete, vissuto circa 2300 anni prima, e che aveva immaginato l’acqua come principio di tutto. Nel XX secolo però la ricerca si era arricchita di nuove teorie, metodologie e strumentazioni che erano più adatte a guidare la mente umana verso conoscenza dell’universo e quindi è giustificato pensare che ai tempi di Levi la verità fosse più vicina. Uno strumento per la comprensione della materia è la Tavola di Mendeleev che contiene simbolo, nome e proprietà di tutti gli elementi conosciuti; essi sono sostanze semplici e pure composte da atomi tutti uguali per numero e sistemazione degli elettroni, ma che possono differire in peso atomico. Gli atomi degli elementi e le molecole che essi formano, costituiscono tutta la materia esistente nell’Universo (2). Questo ci dice che se facciamo una analisi qualitativa su una piccola particella di materia del nostro pianeta o ipoteticamente di qualsiasi corpo celeste di qualsiasi galassia, troveremo soltanto atomi di elementi che sono in una casella della Tavola. Le informazioni sulla composizione dei corpi celesti da noi lontanissimi si possono ottenere analizzando la luce emessa dagli atomi degli elementi che li compongono tramite metodologie spettroscopiche. La luce blu proveniente dagli spazi interstellari certifica la presenza dell’idrogeno, il primo elemento formato dopo il Big Bang (vedi oltre) e il primo elemento della Tavola.https://www.focus.it/scienza/spazio/idrogeno-il-bagliore-invisibile-delluniverso.
(I lettori che vogliono approfondire le caratteristiche chimiche della Tavola di Mendeleev possono trovare informazioni scientifico-divulgative in Appendice).
Con il completamento della tavola periodica e l’acquisizione del concetto di legame chimico, responsabile della formazione delle strutture molecolari, la ricerca prende la strada della sintesi di nuove sostanze chimiche, non esistenti in natura, ma adatte ad applicazioni tecnologiche. Di pari passo vengono ideate nuove strumentazioni che aiutano i chimici ad acquisire informazioni rapide su atomi e molecole e a condurre appropriate analisi qualitative e quantitative.
Anche Levi intraprende “Un’opera di chimico che pesa, divide, misura e giudica su prove certe e s’industria a rispondere ai perché”. Inizialmente egli trova lavoro in una industria che ricupera nichel (elemento della casella 28 della Tavola) da materiali di scarto e poi lavora in una industria di medicinali dove sicuramente avrà costruito nuove molecole, le avrà purificate, ne avrà fatto l’analisi elementare (analisi di tutti gli elementi che compongono la molecola) e ne avrà controllato la purezza. In quel periodo si ha un enorme sviluppo della sintesi chimica in tutti i campi e soprattutto in quello delle materie plastiche che nel 1963 culmina con il premio Nobel per la Chimica assegnato a Giulio Natta e Karl Ziegler per le loro ricerche sul polipropilene.
Ma da dove provengono tutti gli atomi e le molecole (la materia) del nostro pianeta di pietra e dell’universo intero? Questa domanda stuzzicò i fisici e li spinse ad una ricerca approfondita. Abbiamo già visto che essi avevano ottenuto importanti risultati nello studio dell’atomo prima che i chimici incominciassero a costruire le loro molecole. Gli studiosi della fisica dell’universo erano interessati a comprendere la materia e la sua origine; infatti intorno al 1930 nacque una teoria, chiamata del Big Bang (BB), che descriveva la genesi dell’universo in un tempo lontanissimo. La teoria fu opera del fisico e sacerdote belga Georges Lemaître; essa ebbe vita difficile per molti decenni. Quando però incominciò ad avere conferme sperimentale dalle ricerche con gli acceleratori di particelle, dove veniva studiato il comportamento della materia in condizioni estreme, la comunità scientifica mondiale la accettò a grande maggioranza. Guido Tonelli (2), fisico al CERN di Ginevra e professore all’Università di Pisa, ha pubblicato nel 2019 un libro che descrive quello che è successo dopo il BB (avvenuto 13,8 miliardi di anni fa), l’origine di tutti gli elementi dell’universo e quindi anche di quelli che possiamo toccare tutti i giorni sul nostro pianeta. La prima particella stabile che è nata qualche istante dopo il BB è il protone, il nucleo dell’atomo di idrogeno e Tonelli dice “un protone è per sempre”, stabilissimo, “immortale”. Si può dire che i protoni sono tuttora la componente principale della materia dell’universo. Poi si forma il neutrone, neutro come dice il nome, che ha praticamente la stessa massa del protone e che è stabile quando è impacchettato in un nucleo atomico. Infatti, date le condizioni di temperatura esistenti nel momento della formazione di protoni e neutroni essi possono aggregarsi per formare i nuclei degli elementi leggeri, ma non gli atomi. Un protone ed un neutrone formano il nucleo del deuterio (l’idrogeno con massa 2, esso è contenuto nella molecola dell’acqua pesante) e due nuclei di deuterio formano il nucleo di elio (n. 2 della Tavola). Al diminuire della temperatura (con l’allontanamento temporale dal BB) entra in gioco la terza particella necessaria per formare gli atomi degli elementi: l’elettrone, leggerissimo e con carica negativa; in condizioni energetiche favorevoli l’elettrone viene quindi catturato dai nuclei e si formano i primi atomi. Tonelli dice che in quel momento erano passati 380.000 anni dal BB: “Gli elettroni potranno legarsi stabilmente con i protoni e nasceranno i primi atomi”. I primi elementi apparsi nell’universo, circa 9 miliardi di anni prima della formazione del sistema solare, sono il numero 1 e numero 2 della Tavola Periodica: idrogeno ed elio. Questi sono gli elementi più leggeri (massa 1 e 4) e costituiscono, col 75% e 24 % rispettivamente, la stragrande maggioranza dell’universo. Queste percentuali possono stupire un abitante di un pianeta del sistema solare in cui ci sono quattro pianeti rocciosi (Mercurio, Venere, Terra e Marte) ma esse sono certificate dalla scienza e le nuvole di idrogeno si posso vedere brillare nell’universo per le loro caratteristiche righe di emissione. L’emissione blu dell’idrogeno si può osservare su questo sito:
https://www.media.inaf.it/2018/10/02/splendido-splendente-ecco-luniverso-primordiale/.
E per fortuna che c’è idrogeno in abbondanza, perché questo è il carburante che tiene accese le fornaci nucleari (tutte le stelle delle galassie compreso il nostro Sole) producendo elio. L’idrogeno del Sole secondo i fisici, è sufficiente per tenerlo acceso per circa dieci miliardi di anni e questo ci fa stare tranquilli. L’1% degli elementi più pesanti dell’elio sono sparsi negli spazi interstellari, sono presenti anche nei pianeti rocciosi e interessano particolarmente gli abitanti della Terra. Un certo numero, dal litio (n. 3) al ferro (n. 26) sono stati prodotti per nucleosintesi tramite lo scontro di protoni e neutroni ad altissime temperature e velocità con la conseguente formazione di nuovi nuclei; questi poi diventarono atomi catturando elettroni. Il processo fu possibili nelle megastelle formatesi subito dopo il BB che avevano temperature interne idonee alla sintesi dei nuclei; le stelle sono poi esplose disperdendo i materiali sintetizzati negli spazi cosmici. Gli elementi più pesanti della Tavola sono pure stati prodotti da nucleosintesi, ma in condizioni di collisioni catastrofiche di stelle. Recentemente un gruppo di astronomi ha registrato una collisione tra stelle di neutroni che ha avuto la funzione di “fabbrica cosmica di metalli pesanti”:
http://www.blueplanetheart.it/2019/06/collisione-cosmica-creato-della-terra/.
Dopo nove miliardi di anni dal BB inizia a formarsi un raggruppamento di materia che interessa direttamente il nostro pianeta: si forma il sistema solare. Le esplosioni di stelle nei millenni precedenti hanno disperso negli spazi siderali polveri e gas che contengono idrogeno ed elio, ma anche tutti gli elementi della Tavola. Al diminuire della temperatura la forza di gravità incomincia a dominare e a dare forma ad alcuni centri di raccolta di materia. Si formano il sole, che incomincia a irradiare energia bruciando idrogeno e i suoi satelliti gassosi e rocciosi. Tra questi ultimi c’è anche il pianeta Terra che ha rastrellato dalle polveri intersiderali tutti gli elementi oggi presenti con qualche aggiunta di materiale proveniente dai meteoriti. “Tutti i nuclei che compongono il nostro corpo, il calcio delle ossa, l’ossigeno dell’acqua, il ferro dell’emoglobina, hanno attraversato questo passato burrascoso e terribile. Ora gli atomi che hanno formato si sottomettono docilmente alle reazioni chimiche e biologiche che garantiscono la nostra esistenza. Se solo ci potessero raccontare qualcosa della loro infanzia…… prima prodotti in condizioni estreme di temperatura e pressione nel cuore di una stella e poi scaraventati ….. nel vuoto assoluto per miliardi di anni in attesa che si crei una nuova aggregazione” (2). Primo Levi si era appassionato al vagabondare degli atomi nell’universo e immaginò un viaggio, che descrisse nel suo libro “Il sistema periodico”, accaduto ad un “certo atomo” di carbonio. Alla partenza il carbonio di Levi si trovava sulla superficie di una roccia costituita da carbonato di calcio da centinaia di milioni di anni, arrivando “da una lunghissima storia cosmica” che Levi conosce, ma non intende raccontare. Il suo interesse invece è quello di mostrare le trasformazioni che l’atomo ha subito dopo la sua partenza da un oggetto inanimato, come una roccia, per introdursi in una linea di vita. Infatti, dopo aver lasciato la roccia per la cottura in un forno per calce “uscì per il camino e prese la via dell’aria” come anidride carbonica gassosa. Dopo alcuni voli avventurosi si imbatté in una foglia di vite e tramite la luce del sole, si introdusse in una molecola di zucchero che finì in una bottiglia di vino. Passa quindi nel corpo di un bevitore che alla fine lo espelle ancora come anidride carbonica. Il carbonio ritorna con l’aiuto della luce in un ciclo vitale di un cedro del Libano e quindi di un tarlo, per tornare ancora una molecola di biossido di carbonio. Levi conclude che, in media, ogni duecento anni un atomo di carbonio non immobilizzato nella profondità di una roccia, “entra e rientra nel ciclo della vita”. E’ doloroso leggere che l’idea di scrivere l’avventura dell’atomo di carbonio venne a Levi in un momento tristissimo della sua vita. Egli scrive:”Al carbonio, elemento della vita, era rivolto il mio primo sogno letterario insistentemente sognato in un’ora e in un luogo nei quali la mia vita non valeva molto”. Egli chiaramente fa riferimento alla sua detenzione nel campo di Auschwitz dove, invece del camino del forno per calce, vedeva altri scellerati, malvagi e sacrileghi camini.
Questi articoli sono stati scritti a ricordo di Primo Levi nel centenario dalla sua nascita a commento del suo pensiero riportato in “Il Sistema Periodico”:
La nobiltà dell’uomo, acquisita in cento secoli di prove e di errori, era consistita nel farsi signore della materia, e io mi ero iscritto a Chimica perché a questa nobiltà mi volevo mantenere fedele. Vincere la materia è comprenderla e comprendere la materia è necessario per comprendere l’universo e noi stessi e quindi il Sistema Periodico di Mendeleev.
Riferimenti
- Lucrezio. La natura delle cose (Italian Edition) Feltrinelli Editore. Edizione del Kindle.
- Guido Tonelli, Genesi, Feltrinelli, 2019.
- Massimi Teodorani, L’atomo e le particelle elementari, Macro Edizioni, 2007.
Appendice
La Tavola completa (118 elementi) è riportata in figura 3. Una Tavola interattiva si può vedere sul sito: https://www.ptable.com/?lang=it (Control + clic): selezionando un elemento con il cursore, si ingrandisce la casella e si possono vedere tutte le caratteristiche dell’elemento compresi i numeri che descrivono la distribuzione elettronica. Sul sito: https://www.studenti.it/tavola-periodica-spiegazione-riassunto.html (Control+clic) si possono trovare ulteriori informazioni sulla Tavola. Essa è formata da caselle che contengono i nomi e i simboli degli elementi, disposte in 18 colonne o gruppi e 7 righe o periodi. A sinistra in alto, in ogni casella (Figura 4) viene riportato il numero atomico mentre in basso si trova la massa totale (peso), somma di quella dei protoni e dei neutroni. A destra si trova una colonnina di numeri che danno la distribuzione degli elettroni nei vari gusci elettronici. Il valore che vediamo in fondo alla colonnina è quello degli orbitali di valenza ed è importante perché determina le potenzialità di legame e quindi le proprietà chimiche di ogni elemento. Gli atomi disposti nelle caselle di ogni colonna hanno un uguale numero di elettroni di valenza (vedere figura 4 e i siti web riportati) e quindi hanno caratteristiche chimiche simili. Gli atomi sistemati invece in ogni riga o periodo hanno proprietà diverse tra loro perché ognuno ha un elettrone in più del precedente negli orbitali di valenza. Se guardiamo la casella del litio nella seconda riga vediamo tre elettroni in totale, due completano l’orbitale più basso e non hanno nessun gioco nella formazione di legami (la configurazione è come quella dell’elio, gas nobile, inerte) ed un solo elettrone nel guscio di valenza più esterno (colonnina numeri a destra); poi troviamo il berillio che ne ha due e i successivi tre, quattro, ecc. fino al neon che ne ha otto (Figura 3). Con questa sistemazione di elettroni si è completato il così detto “ottetto” di valenza e il neon è un gas nobile che non forma legami con nessuno, esiste solo in forma atomica (il mio professore diceva è come un sasso). Al primo posto nel terzo periodo troviamo il sodio che ha le medesime proprietà del litio (come del potassio che sta sotto) e che ritorna ad avere un solo elettrone nel guscio di valenza e si inizia a riempire un altro ottetto che conduce all’argon, ancora gas nobile non disponibile a formare legami. Quindi periodicamente nelle righe, dopo l’aggiunta degli otto elettroni da sinistra a destra, ritroviamo le stesse proprietà chimiche. Lo stesso accade per gli altri periodi, anche se la comparsa degli elementi della parte rosa della tavola della figura 3 (colonne IIIB, IVB, ecc.) renderebbe troppo lunga e complessa la spiegazione per lo scopo di questo lavoro. In ogni caso comunque, l’ultimo numero in basso della colonnina a destra nella casella indica sempre gli elettroni di valenza; si parte da 1 e si arriva a 8, al gas nobile non reattivo. Questo è il significato di periodico, un ritorno, al crescere del numero atomico, alle stesse proprietà chimiche dopo l’introduzione di altri 8 elettroni. Il numero di legami che l’atomo di ogni elemento può formare non è definibile con una regola semplice e precisa; molti elementi danno luogo a composti diversi variando il numero e il tipo di legame in dipendenza delle loro proprietà chimiche. Ad esempio il ferro (n. 26 della Tavola) può creare nei suoi composti 2, 3 o 6 legami con altri atomi; la molteplicità di legame, anche maggiore e con numeri diversi rispetto al ferro, è seguita dalla maggioranza degli altri elementi. Il rutenio e l’osmio, nei loro tetraossidi, realizzano 8 legami con 4 molecole di ossigeno, il massimo osservato tra tutti gli elementi della Tavola.

Tavola interattiva: https://mehttps://www.ptable.com/?lang=it (Control + clic).

Gian Gaetano Aloisi è stato professore ordinario di Chimica Fisica presso l’Università di Perugia. E’ autore di numerose pubblicazioni su riviste scientifiche internazionali. In molti dei suoi lavori vengono esposte ricerche riguardanti reazioni chimiche indotte da assorbimento di luce. Si è interessato anche della reattività fotoindotta di farmaci antimalarici. Ad esempio: “DNA cleavage induced by photoexcited antimalarial drugs”, pubblicato su Photochemistry and Photobiology, 83, 664, 2007. Arrivato alla pensione nel 2008, si è poi dedicato allo studio della storia antica e della preistoria.
